1. மூலதனம்.
2. மூலப்பொருட்கள்.
3.தொழில்நுட்பம்.
4. சக்தி, மின்சாரம், எரிபொருள்.
5. தொழிலாளர்கள்.
6. போக்குவரத்து வசதிகள்.
7. சந்தை வசதி.
8. கேள்வி.
9. கழிவு முகாமைத்துவம்.
1. நீண்டகாலத்திற்கு பயன்படுத்தக் கூடியதாக பெரியளவில் இருக்கையாக இருத்தல் வேண்டும்.
2. இலகுவாக கிடைக்கக் கூடியதாக இருத்தல் வேண்டும்.
3. தூய்மை சதவீதம் உயர்வாக இருத்தல் வேண்டும்.
பாறை உப்பு – NaCl
கடல் நீர் -NaCl, MgCl2, CaCl2, CaSO4, MgSO4
சிலிவெடி உப்பு -NaNO3
சில்வைன் – KCl
வெண்காரம் – Na2B4O7·10H2O
மக்னசைற்று – MgCO3
டொலமைற்று – CaCO3, MgCO3
சுண்ணாம்புக்கல்- CaCO3
சலவைக்கல் – CaCO3
வெண்கட்டி- CaCO3
கறியுப்பு உற்பத்தியாகும் இடம் உப்பளம் எனப்படும். இலங்கையில் கறியுப்பு தயாரிக்கப்படும் இடங்களில் முக்கியமானவை புத்தளம் , அம்பாந்தோட்டையுமாகும். பாரம்பரிய முறைப்படி தயாரிக்கப்படும்
உப்பளம் அமைவதற்கு உகந்த இடம்:-
செய்முறை : மூலப்பொருள் – கடல்நீர்
− இங்கு உப்பளங்ளில் 3 பாத்திகள் காணப்படும்.
− முதலாவது பாத்தியில் கடல்நீர் நேரடியாக இறைக்கப்படும்.
− பங்கு கடல்நீர் ஆவியாக விடப்படும்போது அதன் செறிவு 3 மடங்கு ஆகையில் CaCO3 வீழ்படிவாகும்.
− பின்னர் மிகுதி நீரை 2ஆம் பாத்திக்கு மாற்றுதல் வேண்டும். இங்கு மேலும் ஆவியாகவிடப்படும்.
− செறிவு 4 மடங்காகும் போது ஜிப்சன் (CaSO4 . 2H2O) வீழ்படிவாகும்.
− மீதி நீர் 3ஆம் பாத்திக்கு செலுத்தப்படும்.
இங்கு மேலும் ஆவியாக விடும்போது செறிவு 10 மடங்காகுகையில் NaCl வீழ்படிவுறும்.
இதிலிருந்து உப்பு பிரித்தெடுக்கப்படும்.பெறப்பட்ட NaCl உப்பு குவிக்கப்பட்டு கிடுகால் மூடப்படும்.
இது Ca²+ , Mg²+ , SO4²¯ அயன்களை மாசாகக் கொண்டிருக்கும்.தூய NaCl நீர்மயமாகாது எனினும் மேற்கூறப்பட்ட மாசுக்களைக் கொண்ட NaCl நீர்மயமாகும்.
− NaCl குவியல் ஆறு மாதத்திற்கு வெளியில் சேமித்து வைக்கப்படும். சேமிக்கும் போது குவிக்கப்பட்டிருக்கும் உப்பில் ; Ca²+, Mg²+ அயன்கள் வளியிலுள்ள நீராவியை உறிஞ்சி கரைசலாக வெளியேறுவதால் NaCl பளிங்கு தூய்மையாக்கப்படும்.
− இக்கரைசலுக்கு KIO3 தேவையான அளவு சேர்க்கப்பட்டு அயடீன் ஏற்றப்பட்ட உப்பு தயாரிக்கப்படும்.
− மிகுதியாக விடப்படும் கரைசல் பிற்றேன் (தாய்திரவம்) எனப்படும்.
− இதில் Mg²+, K+, SO4¯, Cl¯, Br¯ என்பன காணப்படும்.
− தாய்த்திரவத்திலிருந்து Mg உலோகத்தையும் Br ஐயும் பிரித்தெடுக்கலாம்.
− கடல் நீரிலிருந்து பிரித்து எடுக்கப்பட்ட NaCl உப்பை நீரில் கரைத்து நிரம்பிய கரைசல் தயாரிக்கப்படும். இது Brine கரைசல் எனப்படும்.
− இதனுள் HCl ஐ செலுத்துவதன் மூலம் பொது அயன் விளைவாக தூய NaCl விளைவாகும்.
− இதற்கு KIO3 சேரத்து அயடீனேற்றப்பட்ட மேசையுப்பு தயாரிக்கப்படும்.
தாய்திரவத்திற்கு நிரம்பிய Ca(OH)2 கரைசல் இடும்போது Mg(OH)2 வீழ்படிவாகும். இவ்வீழ்படிவு வடித்தெடுக்கப்படும் HCl கரைசல் சேர்க்கப்படும்.
Mg(OH)2 (s) + 2HCl(aq) → MgCl2(aq) + 2H2O(l)
பெறப்படும் MgCl2 கரைசலானது ஆவியாக விடப்படுவதன் மூலம் திண்ம MgCl2 பெறப்படும். இதனை உருக்கி மின்பகுப்பதன் மூலம் Mg ஐ பிரித்தெடுக்கலாம்.
Anode : 2Cl¯(aq) → Cl2(g) + 2e
Cachode : Mg²+(s) + 2e → Mg(s)
தாய்திரவத்திற்கு மேலே பிரித்தெடுப்பின் போது பெறப்பட்ட Cl2(g) ஐ செலுத்தும் போது Bromine பெறப்படும்.
NaCl ன் உபயோகம்
− உணவை சுவையூட்டுவதற்குப் பயன்படும்.
− உணவுப் பொருள் பழுதடையாது பாதுகாக்க உதவும்.
− Na (உலோகம்) , Na2CO3, NaHCO3, NaOH தயாரிக்கப் பயன்படும்.
− Saline தயாரிக்க பயன்படும்.
− பனிக்கட்டியின் உருகுநிலையைக் குறைக்க பயன்படும்.
மக்னீசியத்தின் பயன்கள்
கலப்பு உலோகம் தயாரிப்பு
டியூரலுமின் (Al , Mg , Ca )
மக்னலியம் (Mg , Al )
− இக்கலப்பு உலோகங்கள் விமான உதிரிப்பாகங்கள் தயாரிப்பதற்குப் பயன்படும்.
− இவை தாழ் அடர்த்தி உடையதால் பாரம் குறைந்தவை.
− உயர்வெப்பநிலையில் பொறிமுறைப் பலம் உயர்ந்தவை.
− உயர் அரிப்புத் தடை உடையவை.
− பனிக்கட்டியின் உருகுநிலையைக் குறைக்க பயன்படும்.
மென்தகட்டு முறை
மூலப்பொருள் -Brine கரைசல்
செய்முறை –
பிறைன் கரைசலைத் தூய்தாக்கல்
1.Brine கரைசலுக்கு Na2CO3 இடப்பட்டு Ca²+ ஆனது CaCO3 ஆக அகற்றப்படும்.
2. இக்கரைசலுக்கு NaOH இட்டு Mg²+ ஆனது (Mg(OH)2 ஆக வீழ்படிவாக்கப்பட்டு அகற்றப்படும்.
3. இக்கரைசலுக்கு BaCl2 இட்டு SO4²¯ ஆனது BaSO4 ஆக அகற்றப்படும்.
− தூய்தாக்கலின் போது கரைசலில் Na+ அயன்களும் Cl¯ அயன்களும் மேலும் அதிகரிக்கும்.
− அத்துடன் Brine கரைசலிலிருந்து Mg²+ அயன்களை அகற்றாதுவிடின் மின்பகுப்பின்போது உருவாகும் Mg(OH)2 கன்னார் மென்றகட்டின் நுண்துளைகளை அடைக்கும்.
தூய Brine கரைசலின் மின்பகுப்பு
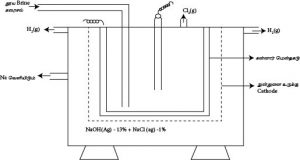
2Cl¯(aq) + 2H2O(l) → H2(g) + Cl2(g) + 2OH¯(aq)
2NaCl(aq) + 2H2O(l) → H2(g) + Cl2(g) + 2NaOH(aq)
1. Anode இல் புறப்படும் Cl2(g) உம் Cathode இல் புறப்படும் H2(g) உம் தாக்கம் புரியாது தடுப்பதற்கு
2. Anode இல் உருவாகும் Cl2 உம் விளைவாகப் பெறப்படும் NaOH உம் தாக்கம் புரியாது தடுப்பதற்கு.
3. Anode இல் பெறப்படும் Cl2 உருக்குக் கதோட்டுடன் தாக்கம் புரியாது தடுப்பதற்கு
4. பெறப்படும் NaOH ஐ பிரித்தெடுப்பதற்கு
NaOH இன் பயன்பாடு
1. சவர்க்காரம் தயாரிப்பு
2. வெளிற்றுங் கருவி (Milton , NaOCl)
பக்கவிளைபொருளின் பயன்பாடு
H2
1. HCl தயாரிப்பு
2. ஏபர்முறை NH3 தயாரிப்பு
3. மாஜரின் தயாரிப்பு
4. எரிபொருள் தயாரிப்பு
Cl2
1. வெளிற்றும் தூள் தயாரிப்பு
2. HCl தயாரிப்பு
Na2CO3(aq) இற்கு நீறிய சுண்ணாம்பை இடும்போது CaCO3 வீழ்படிவாகும். இதை வடித்து அகற்றுவதன் மூலம் பெறப்படும் NaOH(aq) ஐ ஆவியாக்கல் மூலம் செறிவூட்டி NaOH பளிங்கு பெறப்படும்.
இரசக் கதோட்டு முறை:_
மூலப்பொருள் – தூய Brine கரைசல்
செய்முறை
2H2O(l) + 2e → H2(g) + 2OH-(aq)
2H+(aq) + 2e → H2(g)
மென்சவ்வு முறை:-
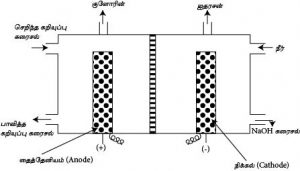
முறை : Solvay அல்லது Ammonia soda முறை
மூலப் பொருட்கள் : 1. தூய Brine கரைசல்
2. NH3 (ஏபர்முறை)
3. சுண்ணாம்புக்கல்
செய்முறை :-
NH3 ஏற்றும் அரண்
NH3 ஏற்றும் அரணில் மேலிருந்து கீழாக பிறைன் கரைசல் துமிக்கப்படும். கீழிலிருந்து மேலாக 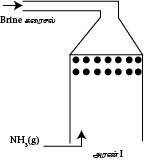 NH3(g) செலுத்தப்படும். இதன்போது NH3(g) Brine கரைசலில் கரையும் அதாவது அமோனியா வாயு நிரம்பிய NaCl கரைசலில் கரைக்கப்படும். இக்கரைசல் NH3 ஏற்பட்ட Brine கரைசல் எனப்படும். இது முரணோட்டச் செயன்முறை எனப்படும் இது ஒரு புறவெப்பத்தாக்கம் ஆகும். எனவே தாழ்வெப்பநிலை சாதகமானது.
NH3(g) செலுத்தப்படும். இதன்போது NH3(g) Brine கரைசலில் கரையும் அதாவது அமோனியா வாயு நிரம்பிய NaCl கரைசலில் கரைக்கப்படும். இக்கரைசல் NH3 ஏற்பட்ட Brine கரைசல் எனப்படும். இது முரணோட்டச் செயன்முறை எனப்படும் இது ஒரு புறவெப்பத்தாக்கம் ஆகும். எனவே தாழ்வெப்பநிலை சாதகமானது.
இச்செயன்முறையின் போது கரைதிறனைஉயர்வாகப் பேணும் பொருட்டு அரணின் வெப்பநிலை உயராது பேணுவதற்காக அரணைச் சுற்றி நீர் ஓடவிடப்படும்.
Anode அறையினுள் தூய Brine கரைசல் செலுத்தப்பட்டு மின்பகுப்பு நிகழ்த்தப்படும். Anode ஆக Ti பயன்படுத்தப்படும். இது Anode இல் உருவாகும் Cl2 உடன் தாக்கம் புரியாது.Cathode ஆக Ni பயன்படுத்தப்படும். கதோட்டறையில் மின்பகுப்பின் போது நீர் செலுத்தப்படும் இங்கு நீர் மின்னிறக்கப்பட்டு H2(g) விடுவிக்கப்படும்.
Anode அறையிலிருந்து Cathode அறையில் உருவாகும் OH- அயன்களுடன் இது NaOH ஐக் கொடுக்கும்.Cathode அறையில் பெறப்படும் NaOH கரைசல் அகற்றப்பட்டு ஆவியாக்கல் மூலம் செறிவூட்டகம்.
இதன்போது NaOH பெறப்படும்
Anode : 2Cl-(aq) → Cl2(g) + 2e
Cathode : 2H2O (l) + 2e → 2H(g) + 2OH-(aq)
Cell Reaction : 2NaOH(aq) + 2H2O(Cl) → H2(g) + Cl2(g) + 2NaOH (aq)
குளோரின் உபயோகங்கள்:-
− புடவைகள் , மரம் , காகிதக்கூடம் ஆகியவற்றை வெளியேற்றுவதற்கு நேரடியாகவே அல்லது வெளிற்றும் கருவி வடிவிலோ பயன்படும்.
− குடிநீரை தூய்தாக்கப் பயன்படும்.
− ஐக்கிய இராச்சியத்தில் கால்பங்கு ஐதரோகுளோரிக் அமிலம் ஐதரசனையும் குளோரினையும் பயன்படுத்தி தொகுக்கப்படும்.
− மக்னீசியம் , தைத்தோனியம் மற்றும் வெள்ளீயம் ஆகியவற்றை பிரித்தெடுக்க பயன்படும்.
− பூச்சிகொல்லி , சாயங்கள் , மருத்துகள் தயாரிக்கப் பயன்படும்.
− பொலிவைனல் குளோரைட்டு ,குளோரினேற்றப்பட்ட இறப்பர் போன்ற பல்பகுதிய பதார்த்தங்கள் தயாரிக்கப் பயன்படும்.
காபனேற்றும் அரண்
காபனேற்றும் அரணில் மேலிருந்து கீழாக NH3 ஏற்றப்பட்ட Brine கரைசல் துமிக்கப்படும். கீழிலிருந்து மேலாக அமுக்கப்பட்ட CO2(g) செலுத்தப்படும். இங்கு சுண்ணாம்புக் கல்லை வெப்பப்படுத்துவதன் மூலம் CO2 பெறப்படும்.
இது ஒரு புறவெப்பத்தாக்கமாகும். எனவே தாழ் வெப்பநிலை சாதகமானது. மீளவும் உயர் வினைதிறனை பெறுவதற்கு எதிரோட்ட பொறிமுறை எனப்படும்.
இங்கு அரணில் CO2(g) இன் கரைதிறனை அதிகரிப்பதற்காகவும் உருவாகும் NaHCO3 இன் கரைதிறைக் குறைப்பதற்காகவும் அரணின் வெப்பநிலை தாழ்வாகக் காணப்படும்.தாழ்வெப்பநிலையில் NaHCO3 யின் கரைதிறன் மிகவும் தாழ்ந்ததாகும். எனவே இது இலகுவாக வீழ்படியும்.
இங்கு பக்க விளைவாகப் பெறப்படும் NH4Cl ஐயும் CaO ஐயும் சேர்த்து வெப்பப்படுத்துவதன் மூலம் பெறப்படும் NH3(g) ஐயும் மீள்சுழற்சிக்குப் பயன்படுத்தலாம்.
இதன் போது பெறப்படும் CaCl2 ஐ தாய்த்திரவத்திற்கு இடுவதன் மூலம் ஜிப்சம் (CaSO4 . 2H2O)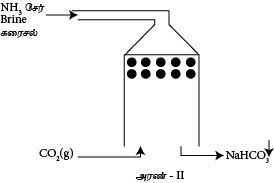 இனைத் தயாரிக்கலாம்.
இனைத் தயாரிக்கலாம்.
NaHCO3 ஐ வெப்பப்படுத்துவதன் மூலம் Na2CO3 ஐ தயாரிக்கலாம். இங்கு பெறப்படும் CO2(g) ஐயும் மீள்சுழற்சிக்குப் பயன்படும்.
காபனேற்றும் அரண்
(1) CaCO3(s) → CaO(s) + CO2(g)
(2) NH3(aq) + H2O(l) → NH4+(aq) + OH-(aq)
(3) OH-(aq) + CO2(aq) → HCO3-(aq)
CO2 மென்னமிலமாதலால் மென்காரமான NH3(aq) இல் நன்கு கரையும். CO2 ஐ மிகையாகச் செலுத்த HCO3-உருவாகும்.
(4) Na+(aq) + HCO3-(aq) → NaHCO3(s)
HCO3– செறிவு அதிகரிக்கும் பொழுது NaHCO3 பளிங்காகும்.
(5) NH4HCO3 + NaCl(aq) → NH4Cl(aq) + NaHCO3↓
(6) NaHCO3(g) → Na2CO3 + CO2↑ + H2O
(7) CaO(s) + H2O(l) → Ca(OH)2(s)
(8) Ca(OH)2 + 2NH4Cl(aq)→ CaCl2(s) + 2NH3↑ + 2H2O
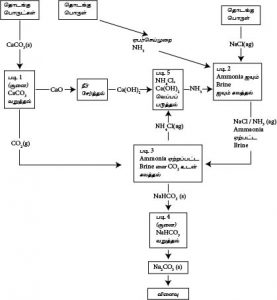
(9) CaCl2 + SO42- → CaSO4 . 2H2O↑ + 2Cl-
(10) 2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
NaHCO3 யின் பயன்பாடு
(1) அப்பச்சோடா உற்பத்தி
(2) தீணயைப்பு கருவிகளில் பயன்படும்
Na2CO3 யின் பயன்பாடு
(1) சலவைச் சேடா தயாரிப்பு
(2) கண்ணாடி தயாரிப்பு
(3) வன்னீரை மென்னீராக்கல்
(4) சவர்க்காரம் தயாரிப்பு
(5) அழுக்ககற்றிகள் தயாரிப்பு
(6) காகிதத் தயாரிப்பு
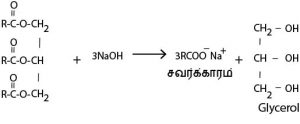
கைத்தொழில் ரீதியில் சவர்க்காரத் தயாரிப்பு 4 படிகளைக் கொண்டது
மூலப்பொருள் – தாவர / விலங்குக் கொழுப்பு
படி – 1 சவர்க்காரமாக்கல்
இச்செயன்முறையின் போது tallow எனப்படும் விலங்குக் கொழுப்பு , தேய்காய் எண்ணெய் அல்லது தாவர எண்ணெய் கணிக்கப்பட்ட அளவு NaOH கரைசலில் கலங்கிய வண்ணம் சுமார் 90ºC வரை வெப்பமாக்கப்படும். இதன்போது திண்ம சவர்க்காரம் உண்டாகும். இது நீண்ட காபன் சங்கிலியை உடைய காபொட்சிலிக்கமிலத்தின் உப்பாகும்.
படி – 2 Glycerin ஐ அகற்றல்
சவர்க்காரத்தை விட Glycerin பெறுமதிமிக்கது. விலை கூடிய அழகு சாதனப்பொருட்கள் தயாரிக்கப் பயன்படும். ஒரு பகுதி கிளிசரீன் சவர்க்காரத்தை மென்மையாக்கவும் , அழுத்தமாக்குவதற்காகவும் சவர்க்காரத்துடன் விடப்படும்.
படி – 3 சவர்க்காரத்தை தூய்மையாக்கல்
தூய்மையாக்கலின் போது மிகுதியாக சவர்க்காரத்திலுள்ள NaOH , சித்திரிக் அமிலம் போன்ற மென் அமிலத்தினால் நடுநிலையாக்கப்படும். மிகுதியாக உள்ள நீரின் 2/3 பகுதி அகற்றப்படும் இதன் மூலம் தூய சவர்க்காரம் பெறப்படும்.
படி – 4 முழுமையாக்கல்
− சவர்க்காரத்தின் கைத்தொழில் முறை தயாரிப்பில் இறுதிப்படியில் நிறச்சாயம் , தற்காப்பி , வாசனைப்பொருள் ஆகியன சேர்க்கப்பட்டு அவை சவர்கார கட்டிகளாக வடிவமைக்கப்பட்டு விற்பனைக்கு விடப்படும்.
− NaOH இற்கு பதிலாக KOH ஐ பயன்படுத்தலாம். KOH ஐ உபயோகிக்கும் பொழுது சவர்க்காரம் தோலுக்கு மென்மையைத் தரும். பிரதானமாக குழந்தைகளுக்கான சவர்க்கார தயாரிப்பில் KOH பயன்படுத்தப்படும்.
− சவர்க்காரத்திலுள்ள RCOO-Na+ இன் நூற்று வீதம் , மொத்தக் கொழுப்பு பதார்த்தத்தின் பெறுமானம் (TFM) எனப்படும்.
சவர்க்காரத்தின் அழுக்ககற்றல் செயற்பாடு
சவர்க்காரம் நீரில் கரையும் போது உருவாகும் அன்னயன் பகுதியில் நீர் விருப்புடைய COO- கூட்டத்தைக் கொண்ட தலைப்பகுதியில் நீண்ட சங்கிலியை உடைய நீர் வெறுப்பை உடைய Alkyl கூட்டத்தைக் கொண்ட வாற்பகுதியில் காணப்படும் சேதன அழுக்கில் வால்பகுதி கரையக் கூடியதாக இருக்கும். இதனால் இவ்வழுக்கு மறை ஏற்றத்தைப்பெறும். நீரில் Na+ அயன்கள் காணப்படும். இதனால் ஏற்படும் கவர்ச்சி காரணமாக அழுக்குத் திரண்டு வெளியேறி நீரில் மிதக்கும்.
நீறாத சுண்ணாம்பு CaO தயாரிப்பு
மூலப் பொருட்கள் – முருங்கைக்கல்
சலவைக்கல்
சிப்பியோடு
செய்முறை :-
நீறாத சுண்ணாம்பு வீட்டுக் கைத்தொழிலில் பாரம்பரிய முறைப்படி தயாரிக்கப்படும். இங்கு சூளையில் விற்கும் மூலப்பொருட்களும் மாறிமாறி அடுக்கப்பட்டு சூளையின் அடியில் நெருப்பு வைக்கப்படும்போது தீ மெதுவாக மேல்நோக்கிப் பரவும்.
உயர்வெப்பநிலை CO2 ஐ வெளியேறச் செய்வதினால் CaO சூளையினுள் மிகுதியாக விடப்படும். சூளை குளிரடைந்த பின் அடியிலிருந்து நீறாத சுண்ணாம்பு அகற்றப்படும்.
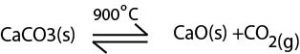
இச்செயன்முறையின் பிரதிகூலங்கள்
(1)CaCO3 பிரிகை வெப்பநிலை (900ºC) ஒப்பீட்டளவில் உயர்வானது. மூலப்பொருட்கள் முழுவதும் இவ்வெப்பநிலையை எட்டுவது கடினம். இதனால் பிரிகை முற்றுப்பெறாது. விறகு எரிதலின் போது இவ்வெப்பநிலை வழங்கப்படாவிடில் CaCO3 முற்றாக பிரிகையடையாது போகலாம்.
(2)பெறப்படும் விளைவுடன் விறகெரித்தலின் போது உருவாகும் சாம்பல் கலக்கும். அத்துடன் மூலப்பொருட்களில் காணப்படும் மாசுகளும் விளைவு கலக்கும். இப்பிரிகைத் தாக்கம் ஓர் சமனிலைத் தாக்கமாகும்.அத்துடன் இது அகவெப்பத்திற்குரியது. CO2 முற்றாக சூளையிலிருந்து வெளியேறாவிடின் அது மீளவும் CaO உடன் இணைந்து CaCO3 ஐ தோற்றுவிக்கலாம். அத்துடன் விளைவை அகற்றும் பொருட்டு சூளையைக் குளிரவிடும்போது சமனிலை இடப்புறம் நகர்வதால் விளைவு குறையும்.
(3)வெப்பம் வெளியேற்றப்படுவதால் சூழல் மாசாக்கப்படும்.
(4)CO2 மற்றும் நுண்ணிய துகள்கள் வெளியேற்றப்படுவதால் சூழல் மாசாக்கப்படும்.
கல்சியம் ஒட்சைட்டின் பயன்கள்
(1) நீறிய சுண்ணாம்பு , சுண்ணாம்பு பால் தயாரிப்பிலும் பயன்படும்.
(2) கல்சியம் காபைட்டின் பெரும்படி தயாரிப்பு
(3) மண்ணின் அமிலத் தன்மையை குறைக்க
(4) வெளிற்றும் தூள் தயாரித்தலில்
(5) அமோனியா பெரும்படி தயாரிப்பு
(6) கட்டட நிர்மாணக் கைத்தொழிலில்
(7) அமில வாயுக்களை அகத்துறிஞ்சலில்
நீறாத சுண்ணாம்பிற்கு சிறிது சிறிதாக நீரைச் சேர்ப்பதன் மூலம் நீறிய சுண்ணாம்பு தயாரிக்கப்படும்.
CaO + H2O → Ca(OH)2
பயன்பாடு
(1) கட்டிட நிர்மாணத் துறை
(2) வெளிற்றும் தூள் தயாரிப்பு
நீறாத சுண்ணாம்பை கற்கரியுடன் மின்வில்லின் 2000ºC யிற்கு வெப்பப்படுத்துவதன் மூலம் CaC2 ஐத் தயாரிக்க முடியும்.
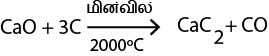
பயன்பாடு
(1) அன்னாசி பூத்தலைத் தூண்டுதல்
(2) அசற்றலீன் தயாரிப்பு
CaC2 க்கு நீர் சேர்ப்பதன் மூலம் அசற்றலீன் தயாரிக்கப்படும்.
CaC2 + 2H2O → C2H2↑ + Ca(OH)2
பயன்பாடுகள்
அசற்றலீன் வாயு ஒட்சிசனுடன் க→லக்கப்பட்டு எரிக்கும் போது உருவாகும் சுவாலை ஒட்சி அசற்றலீன் சுவாலை எனப்படும்.
வெளிற்றும் தூள் தயாரிப்பு :-
சுண்ணாம்புக் கல்லை வெப்பமேற்றி நீறாத சுண்ணாம்பு பெறப்படும் (CaO)
நீறிய சுண்ணாம்பை (Ca(OH)2(s)) பெறுவதற்கு நீரானது CaO மேல் தெளிக்கப்பட்டு குளிரவிடப்படும்.
ஈரமான திண்ம Ca(OH)2 மேல் சூழலும் சூளையில் 12 – 15 hours Cl2(g) செலுத்தப்பட்டு கலவை சூளையுள் பொருத்தப்பட்ட இறாக்குகள் மூலம் விட்டுவிட்டு கலக்கப்படும்.உயர் வினைதிறனை பெறுவதற்கு எதிரோட்ட பொறிமுறை பயன்படுத்தப்படும்.
CaCO3(s) → CaO(s) + CO2(g)
CaO(s) + H2O(s) → Ca(OH)2(s)
3Ca(OH)2(s) + 2Cl2(g) → Ca(OCl)2 . CaCl2 . 2H2O(s)
வெளிற்றும் தூளின் உபயோகம்
(1) வெளிற்றும் கருவியாகப் பயன்படும்
(2) சுத்திகரிப்பில் பயன்படும்

குறிப்புக்கள் ஒழுங்கற்று கலந்து விட்டன