மீளாத தாக்கம்
மீளும் தாக்கம்
CrO42-(aq) + 2H+(aq) ↔ Cr2O72-(aq) + H2O(l)
நித்திய நிலையில் உள்ள தொகுதி
இயக்கச் சமநிலையின் வகைகள்
மூடிய தொகுதி ஒன்றில் ஏற்படும் இயக்கச் சமனிலை 4 வகைப்படும்.
இரசாயனச் சமநிலை
உதாரணம் : 2NO2(g) ↔ N2O4(g)
CaCO3(s) ↔ CaO(s) + CO2(g)
மின்வாய்ச்சமநிலை
அவத்தைச் சமநிலை
உதாரணம் : H2O(l) ↔ H2O(g)
அயன்சமனிலை
உதாரணம் : Mg(OH)2(g) ↔ Mg2+(aq) + 2OH–(aq)
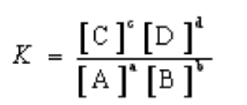
மூலர்செறிவுடன் தொடர்புடைய சமநிலை மாறிலி ( Kc)
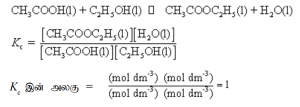
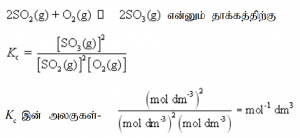
பகுதியமுக்கங்கள் தொடர்ப்பான சமனிலை மாறிலி (Kp)
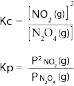
| ஆரம்பம் | 1 | 0 | 0 |
| சமநிலையில் | 1 – α | α | α |
| n( 1 – α ) | nα | nα | |
| மொத்தகளவளவு V என்க | n/V( 1 – α ) | nα/V | nα/V |
| c( 1 – α ) | cα | cα |
மூடியதொகுதி ஒன்றில் உள்ள இயக்கச் சமநிலையில் உள்ள தொகுதி ஒன்றிக்கு சமநிலையைப் பாதிக்கக் கூடிய பௌதீக காரணி ஒன்றை பிரயோக்கும் போது இயலுமானவரை பழைய நிலையை அடையும் பொருட்டு சமநிலைக் கூறுகளின் அமைப்புக்களை மாற்றியமைப்பதன் மூலம் புதிய சமனிலை ஒன்று உருவாகும்.
இலெச்சற்றிலியின் தத்துவத்தை வாய்ப்புப் பார்த்தல்
செறிவு Fe3+(aq) + SCN–(aq) → [Fe(SCN)]2+(aq)
வெப்பநிலை
அமுக்கம்
