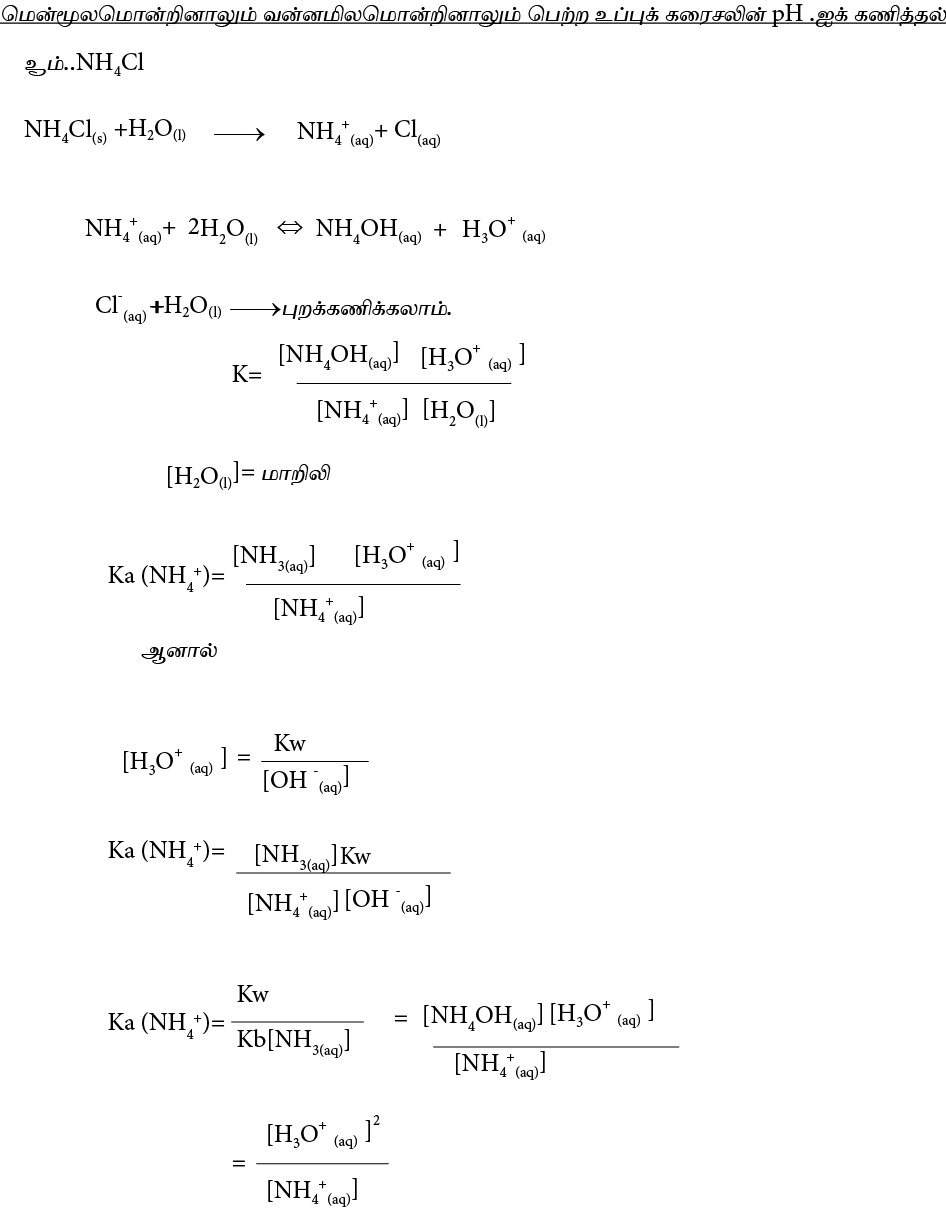
அயன் சமனிலை
நீரின் அயனாக்கமும் நீரின் அயன் பெருக்கமும்
நீர் எவ்வளவுதான் தூயதாக இருப்பினும் மிக சிறிதளவு அயனாகக் கூடியது. இதன்போது H+ ஆகவும்,OH –ஆகவும் பிரிகையடையும்.
H2O (l) ⇔ H3O+ (aq) + OH– (aq)
H2O (l) ⇔ H+ (aq) + OH– (aq)
அது ஓர் அமில – மூல சமனிலையாகும். சமனிலை விதியை பிரயோகிக்க,
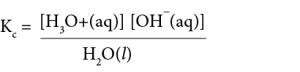
திரவம் மிகையளவில் காணப்படுவதோடு தூயநிலையில் சமனிலையில் காணப்படுவதால் செறிவு மாறிலியாகும்.
H2O (l)] = மாறிலி
KC X [H2O (l)] = [H3O+(aq)] [OH–(aq)]
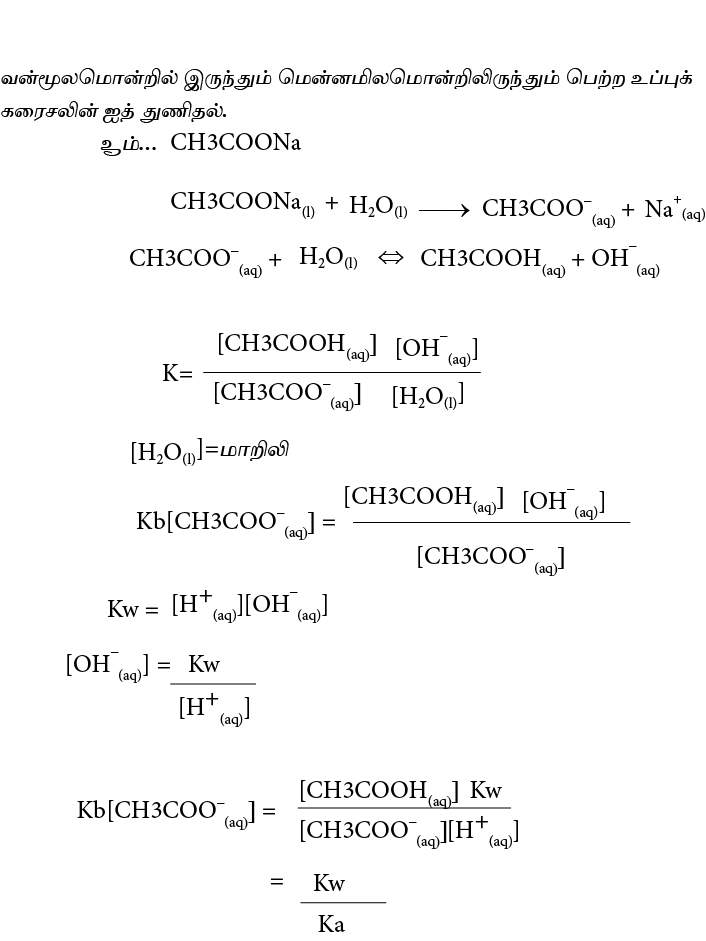
Kw= [H3O+(aq)][OH-(aq)]
H3O+(aq) = [OH-(aq)] = 1 × 10-7 mol dm-3
25°c யில் =1.0 × 10-14 mol2 dm-3 முறு வெப்பநிலையில் மட்டும் தங்கியிருக்கும்.
நீரின் அயனாக்கல் தாக்கம் ஓர் அகவெப்பத்தாக்கமாகும்.
H2O(l) – [H+(aq)] [OH-(aq)]
வெப்பநிலையை அதிகரிக்கும் போது இலட்சட்லேயரின் தத்துவப்படி வெப்பநிலையைக் குறைக்கும் முகமாக அகவெப்பத்திசையான வலப்புறம் சமனிலை நகரும்.
இதனால் Kw ப் பெறுமானம் அதிகரிக்கும். 80°c யில் – 1.0 × 10-12 mol2dm-3
PH பெறுமானம்
கரைசல்களில் காணப்படும்H3O செறிவு சிலவேளைகளில் குறைவானதாகும். பெரும்பாலான சந்தர்ப்பங்களில் ர்3ழு10 ஆனது 10-5 இலிருந்து 10 moldm-3 வீச்சில் காணப்படும்.
நீர்க்கரைசல் ஒன்றில் காணப்படும் H+ அயன்செறிவின் தலைகீழ் பெறுமானத்தின் பத்தின் அடியாகக் கொண்ட மடங்கை பெறுமானம் pH எனப்படும்.
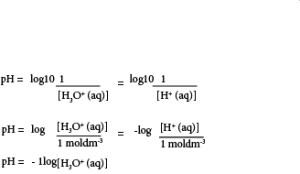
கோவையின் மறை (-) அடையாளம் காரணமாக ஐதரசன் அயன் செறிவு அதிகரிக்கும் போது pH குறைவடையும்.
pH அளவுத் திட்டத்தில் ஒரு அலகின் வித்தியாசம் ஐதரசன் அயன் செறிவின் 10 மடங்கு வேறுபாட்டுக்கு ஒத்தது.
கரைசல் ஒன்றில் காணப்படும் OH- அயன் செயறிளவு pH இல் பின்வருமாறு குறிப்பிடலாம்.
POH = log 10[OH-(aq)]
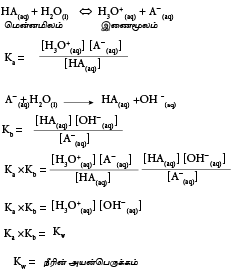
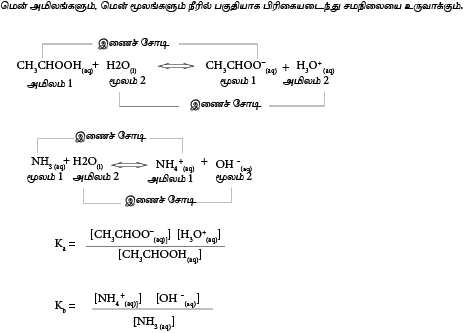
மென்னமிலம் ஒன்றின் கூட்டற்பிரிகை மாறிலி (Ka)
HA(aq) +H2O(l) ⇔[H3O+(aq)]+ A-(aq)
மென்னமிலத்தின் ஐதாக்கலுடன் கூட்டற்பிரிவின் அளவும் அதிகரிக்கும்.
மென்னமிலம் ஒன்றின் முய அதிகரிக்கும்போது அதன் அமிலவலிமையும் உயர்வாக இருக்கும்.
மென்னமிலம் ஒன்றின் கூட்டற்பிரிகை மாறிலி (Ka)

Ka= அமில கூட்டற்பிரிகை மாறிலி
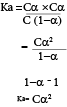
மென்னமிலத்தின் ஐதாக்கலுடன் கூட்டற்பிரிவின் அளவும் அதிகரிக்கும்.
மென்னமிலம் ஒன்றின் முய அதிகரிக்கும்போது அதன் அமிலவலிமையும் உயர்வாக இருக்கும்.
மென்மூலத்தின் கூட்டற்பிரிகை மாறிலி(Kb)
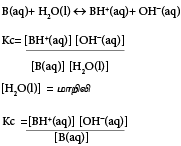
Kb =மென்மூலத்தின் கூட்டற்பிரிகை மாறிலி
மென் மூலகங்களின் pKb பெறுமானம் அதிகரிக்கும் போது அவற்றின் மூல் வலிமை குறையும்.
PKa = -log10 Ka
PKb = -log10 kb
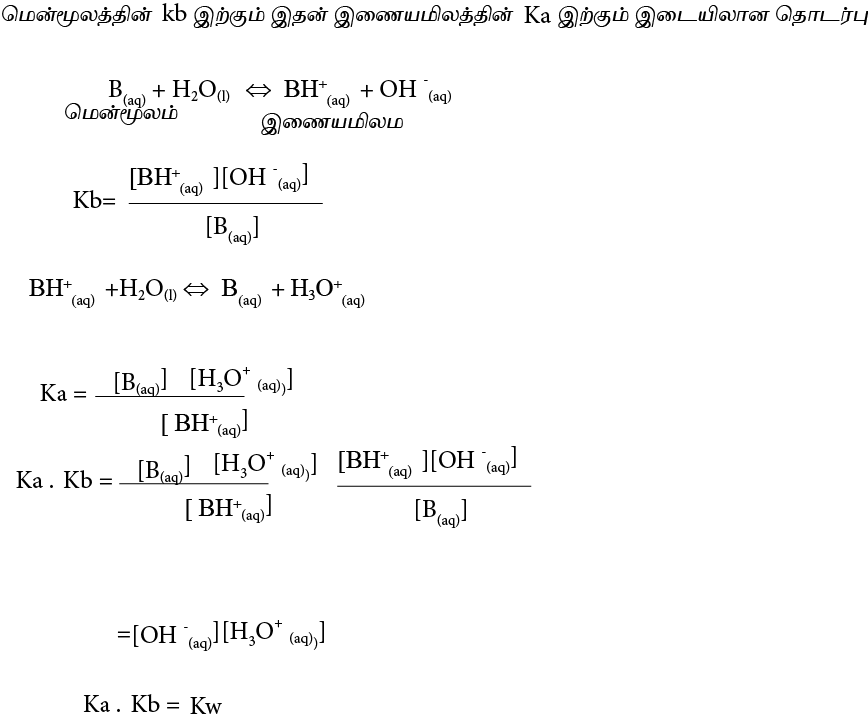
மென்னமிலத்தின் Ka இற்கும் Kb இற்கும் இடையிலான தொடர்பு


காட்டிகள் தொடர்பான கொள்கை
எந்த அமில – மூலக் காட்டியும் மென்னமிலம் அல்லது மென்மூலம் ஆகும். இவை ஒரு குறிப்பிட்ட PH பெறுமானத்திற்குக் கீழே ஒரு நிறத்தையும் ஒரு குறிப்பிட்ட PH பெறுமானத்திற்கு மேலே வேறொரு நிறத்தையும் காண்பிக்கும்.
அமில – மூல காட்டியை மென்னமிலமாக கருதலாம். இது HIn இனால் குறிப்பிடப்படும்.
HIn உம் In- உம் இரண்டு வேறான நிறங்களைக் கொண்டவை.
அமிலமொன்றை சேர்க்கும் போது சமனிலையானது இடது புறத்தை சாருவதால் HIn இன் நிறம் தெரியும். colour1 தெரியும்
மூலமொன்றை சேரக்கும்போது H3O+ நீக்கப்பட்டு சமனிலை வலதுபுறமாக நகரும். In- இன் நிறம் முதன்மை பெறும். எனவே colour2 தெரியும்.
தாழ் PHஇல் நிறம் I தோன்றுவது தாழ் நிறம் என்றும், உயர் PH இல் நிறம் 2 தோன்றுவது உயர்நிறம் என்றும் கூறப்படும்.
காட்டியொன்றின் PH வீச்சு PKIn + 1 இற்கும் PKIn – 1 இற்கும் இடையே அமையும் போது அண்ணளவாக இரண்டு PH அலகுகளுக்கு இடையில் நிறமாற்றம் ஏற்படும்.
| காட்டி | PH வீச்சு | தாழ் PH எல்லைக்கு கீழ் உள்ள நிறம் | உயர் PH எல்லைக்கு மேலுள்ள நிறம் | PH |
| 1. Methyl orange | 2.9 – 4.6 | சிவப்பு | மஞ்சள் | 3.7 |
| 2. Methyl red | 4.2 – 6.3 | சிவப்பு | மஞ்சள் | 5.0 |
| 3.Bromothymol blue | 6.0 – 7.6 | மஞ்சள் | நீலம் | 7.1 |
| 4.phenolphthalein | 8.3 – 10.0 | நிறமற்றது | சிவப்பு | 9.6 |
முடிவுப்பள்ளி
அமில – மூல நியமிப்பு ஒன்றின்போது காட்டி நிறமாற்றத்தைக் காட்டும் புள்ளி முடிவுப் புள்ளி எனப்படும்
.
சமவலுப் புள்ளி
அமில – மூல நியமிப்பில் நடுநிலையாக்கும் முற்றுப்பெறும் புள்ளி சமவலுப்புள்ள எனப்படும்.
அமில – மூல நியமிப்பு
011mol dm-3 NAOH கரைசலின் 25.00cm-3 இற்கும் 0.1 moldm-3 HCl கரைசலை துளித்துளியாக இட்டு PH இற்கும் சேர்க்கப்பட்ட அமிலத்தின் கனவளவுக்கும் வரைபு வரையப்படும்.
வன்மூல வன்அமில நியமிப்பில் முடிவுப்புள்ளிக்கு அண்மையில் திடீர் மாற்றத்தைக் காட்டக்கூடிய PH வீச்சினுள் காணப்படக் கூடிய வீச்சைக் கொண்ட காட்டிகள் எல்லாவற்றையும் நியமிப்புக்கு பயன்படும்.
பினோப்தலீன் methyl orange பாசிச்சாயம் பயன்படுத்தலாம். ஆனால் முடிவுப்புள்ளியில் கரைசலின் PH உம் காட்டி யின் PKIn உம் ஒத்ததான காட்டி மிகச்சிறந்தது. பாசிச்சாயம் மிகப்பொருத்தமானது.
