மூலப்பொருட்கள்
− மூலப்பொருட்களாக நைதரசன்,ஐதரசன் வாயுக்கள் பயன்படும்.
− திரவ வளியை பகுதிபட காய்ச்சி வடிப்பதன் மூலம் நைதரசன் பிரித்தெடுக்கப்படும்.
− இயற்கை வாயுவிலிருந்தும்,நப்தாவிலிருந்தும் பின்வருமாறு ஐதரசன் பிரிக்கப்படும்.
C6H14(g) + 3O2(g) → 6CO(g) + 7H2(g)
(நப்தா)
2CH4(g) + O2(g) → 2CO(g) + 4H2(g)
இயற்கை வாயு அல்லது நீராவியுடனான பகுதி ஒட்சியேற்றம்
C6H14(g) + 6H2O(g) → 6CO(g) + 13H2(g)
(நப்தா)
CH4(g) + H2O(g) →Ca(g) + 3H2(g)
இயற்கை வாயு
∗நைதரசனும், ஐதரசனும் தாக்கமுற்று அமோனியாவைக் கொண்ட சமனிலை கலவையை உருவாக்கும்.
![]()
∗இலிச்சற்றிலியரின் தத்துவப்படி உயர் அமுக்கமும் குறைந்த வெப்பநிலையும் சமநிலையின் போது அமோனியாவின் அளவைக் கூட்டும்.
பெறப்படும் NO(g) குளிரவிடப்பட்டு O2(g) உடன் கனவளவு ரீதியில் 2 : 1 என்ற விகிதத்தில் கலந்து 150ºC யில் தாக்கம் புரியவிடுவதன் மூலம் NO2(g) ஐப் பெறமுடியும்.
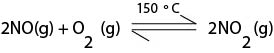
முறை – 1
பெறப்படும் NO2 வாயுவிற்கு மிகையான வளி சேர்த்து பின்னர் நீர் சேர்ப்பதன் மூலம் HNO3 ஐத் தயாரிக்க முடியும்.
4NO2(g) + O2(g) + 2H2O(l) → 4HNO3(l)
மிகைவளி
முறை – 2
NO2(g) இற்கு நேரடியாக நீர் சேர்க்கப்படும்.
2NO2(g) + H2O(l) → HNO2(l) + HNO3(l)
இதன்போது பெறப்படும் HNO2 மிகவும் உறுதி குறைந்தது. இதன் பிரிகையால் பெறப்படும் NO(g), NO2(g) என்ப வற்றை மீள்சுழற்சிக்கு பயன்படுத்த முடியும்.
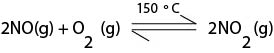
2NO2(g) + H2O(l) → HNO2(aq) + HNO3(aq)
2HNO2(aq) → NO + NO2 + H2O
∗மேலே செயற்பாடுகளின் போது பெறப்படும் HNO3 திணிவு ரீதியில் 60% ஐக் கொண்டிருக்கும். இதை பகுதிபட காய்ச்சி வடிப்பதன் மூலம் மாறாக் கொதிநிலைக் கலவை (125.5ºC) பெறப்படும். இதில் HNO3 திணிவு ரீதியில் 68% காணப்படும்.
மேலும் தூயநிலையில் HNO3 தேவைப்படின் நீரகற்று கருவியை பயன்படுத்தி நீரகற்றுவதன் மூலம் பெறமுடியும்.
∗இதற்கான நீரகற்று கருவியாக,
(1) P2O5
(2) con H2SO4 பயன்படும்.
பௌதீக இரசாயனத் தத்துவங்கள்
மேற்படித் தாக்கம் ஏவற்சக்தி உயர்ந்த ஒரு தாக்கமாகும். இங்கு Pt – Rh ஊக்கி பயன்படுத்தப்படும். இது புறத்துறிஞ்சற் கொள்கைக்கு அமைய ஏவற்சக்தியை குறைத்து தாக்கவீதம் அதிகரிக்கச் செய்கிறது.
இங்கு உயர்வெப்பநிலை 850ºC பயன்படுத்துவதால் தாக்கவீதம் அதிகரிக்கப்படும். மேலும் அமுக்கம் (7 – 8atm) உயர்வாக பயன்படுவதால் தாக்கிகளின் செறிவு தாக்க வீதம் அதிகரிக்கும்.
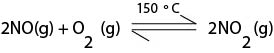 ΔHθ = 112kJmol¯¹
ΔHθ = 112kJmol¯¹
∗மேலே தாக்கம் புறவெப்பத்திற்குரியது. இங்கு தாழ்வெப்பநிலையில் உயர்ந்த விளைவு பெறப்படும். ஆனால் தாக்கவீதம் தாழ்வாகக் காணப்படும்.உயர் அமுக்கம் உயர் விளைவை உருவாக்கும். ஆயினும் அமுக்கத்தை ஏற்படுத்தவும், அவ்அமுக்கத்தை தாங்கக் கூடிய உபகரணச் செலவீனமும் அதிகமாக இருப்பதால் தற்காலத்தில் 250 வ. அ பயன்படும்.
∗தாழ் வெப்பநிலை உயர் அமோனியா விளைவைக் கொடுக்கும். ஆயினும் தாழ் வெப்பநிலையில் தாக்கவேகம் மந்தமாக இருப்பதால் பொருளாதார ரீதியாக சிறந்த விளைவை பெறுவதற்கு 450ºC பயன்படுத்தப்படுகிறது. இத்தாக்கம் புறவெப்பத் தாக்கமாகையால் தொகுதியானது குளிர் நிலையில் பேணப்பட வேண்டும்.
∗இங்கு இரும்பு ஊக்கியும், சிறிதளவு ஊக்கித் தூண்டிகளாக பொற்றாசியம் ஒட்சைட்டு, அலுமினியம் ஒட்சைட்டும் பயன்படும்.
∗அமுக்கத்தை பிரயோகித்து வாயுக்களை குளிரூட்டி திரவ அமோனியா அகற்றப்படுகின்றது. ஏனெனில் குறைந்த செறிவிலான அமோனியாவானது முன்முகத் தாக்கத்தின் அளவைக் காட்டும்.
அமோனியாவின் உபயோகங்கள்:-
(1) நைத்திரிக் அமிலம்,வளமாக்கிகள்,நைலோன் ஆகியவற்றின் உற்பத்திக்குப் பயன்படும்.
(2) பண்படுத்தப்படாத எண்ணெயிலுள்ள அமிலக் கூறுகளை நடுநிலையாக்க பெற்றோலியக் கைத்தொழிலில் NH3 பயன்படும்.
(3) கந்தகத்தைக் கொண்ட எரிபொருளின் தகனத்தின்போது வெளியேறும் SO2 வை நடுநிலையாக்க புகைபோக்கிகளில் பயன்படும்.
(4) கைத்தொழில் சம்பந்தமான (உணவு,குடிபானம்,குளிரூட்டல்,களஞ்சிய தொழிற்சாலைகளிலும்) குளிரூட்டும் தொகுதிகளில் குளிர்ச்சியூட்டும் பொருளாக பயன்படும்.
(5) இயற்கை,தொகுப்பு மரப்பால் ஆனது காலத்திற்கு முந்தி ஒருங்கொட்டாது தடுப்பதற்கு இறப்பர் கைத்தொழிலில் பயன்படும்.
(6) நீர்,கழிவு நீர் பரிகரிப்பில் pH ஐ கட்டுப்படுத்தவும் மென் அன்னயன்களை மாற்றீடு செய்யும் ரெசின்களை புனருத்தாரனம் செய்யவும் பயன்படும்.
HNO3 தயாரிப்பு (Ostwald process)
மூலப்பொருட்கள்:-
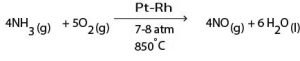
∗NH3(g),வளியையும் 1 : 9 கனவளவு விகிதத்தில் கலந்து 7 – 8 atm அமுக்கத்தில் 850ºC வெப்பநிலையில் உள்ள Pt – Rh ஊக்கி மீது செலுத்துவதன் மூலம் NO(g) பெறப்படும்.

∗மேற்படி தாக்கத்தின் ஏவற்சக்தி உயர்வானதாகும். இதற்கு Pt – Rh ஊக்கியை பயன்படுத்தி ஏவற்சக்தியை குறைத்து தாக்கவீதம் அதிகரிக்கச் செய்யப்படும்.மேலும் வெப்பநிலையை 850ºC யிற்கு அதிகரிப்பதன் மூலம் தாக்கவீதத்தை அதிகரிக்க முடியும். அத்துடன் அமுக்கத்தை தாக்கவீதம் அதிகரிக்கும் பொருட்டு 7 – 8 atm உயர்த்த முடியும்.
∗எனவே ஓரலகு நேரத்தில் உயர்ந்த விளைவை பெறும் பொருட்டு சிறப்பு வெப்பநிலையாக 150ºC பயன்படும். இந்நிபந்தனையின் கீழ் உயர்ந்தளவில் விளைவு பெறப்படக் கூடியதாக இருப்பதால் ஏனைய அமுக்கம் போன்ற நிபந்தனை அவசியமற்றது.
HNO3 யின் பயன்பாடு:-
(1) வளமாக்கி தயாரிப்பு
(2) வெடிபொருட்கள் தயாரிப்பு
(3) வாகன உதிரிப்பாகங்கள் துருப்பிடிக்காமல் இருக்க செறிந்த HNO3 இல் அமிழ்த்தி எடுக்கப்படும்
(4) புகைப்படத் துறையில் AgNO3 தயாரிப்பு
(5) அரசநீர் தயாரிப்பு
யூரியா தயாரிப்பு
மூலப்பொருட்கள்:-
NH3
சுண்ணாம்புக்கல்
செய்முறை:-
∗சுண்ணாம்புக் கல்லை வெப்பப்படுத்தவதன் மூலம் CO2(g) பெறப்படும்.
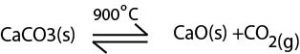
∗திரவ NH3 உம், CO2 உம் தொழிற்படும் தொகுப்பு தாக்கிகளிற்குள் சேர்க்கப்பட்டு 130ºC – 150ºC வரை 35atm அமுக்கத்திலும் தாக்கம் புரிய விடப்படும். இதன்போது Ammonia Carbonate உருவாகும்.
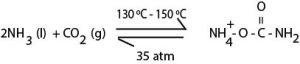
∗இதுவோர் விரைவான புறவெப்பத்தாக்கமாகும். மேற்படி நிபந்தனையில் தாக்கத்தின் பெரும்பகுதி நிறைவுறும்.
∗பெறப்படும் து Ammonium Carbonate ஆனது தாழ் அமுக்கத்தில் பிரிகையாக்கியின் ஊடு செலுத்தி வெப்பமாக்கப்படும். இதன்போது யூரியா கரைசல் உருவாகும்.
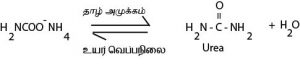
∗மெதுவான அகவெப்பத்தாக்கமாகும் 50 – 80% வரை விளைவு உருவாகும்.
∗பெறப்படும் யூரியா கரைசலானது ஆவியாக்கல் மூலம் செறிவாக்கப்படும். இதன்போது யூரியா பளிங்குகள் உருவாகும்.

யூரியாவின் பயன்பாடு:-
(1) உயர்ந்தளவு Nitrogen ஐக் கொண்ட (46%) திண்ம வளமாக்கியாகப் பயன்படும்.
(2) யூரியா formaldehyde polymer தயாரிப்பு.
பொஸ்பேற்று வளமாக்கி தயாரிப்பு
∗இலங்கையில் எப்பாவெலையில் அப்பறைற்று கனிமம் உயர்ந்தளவில் காணப்படுகிறது.
Ca5(PO4)3 X [X = F / Cl / OH]
∗NPK அடிக்கட்டுப் பசளையும் Phosphorus இற்கான Apatite ஐ பயன்படுத்தமுடியும். ஆனால் இதன் கரைதிறன் மிகவும் குறைவாகும். இதனால் தென்னை போன்ற நீண்டகால பயிர்களுக்கு இதனைப் பயன்படுத்தமுடியும். ஆனால் நெல் போன்ற குறுகிய கால பயிர்களுக்கு பயன்படுத்தமுடியாது.
∗எனவே இதனை கரையக்கூடிய பதார்த்தமாக மாற்றுதல் வேண்டும். இதற்காக H2SO4/HNO3/HCl/H3PO4 ஐப் பயன்படுத்தி super phosphate ஆக்கமுடியும்.
Apatite ஐ நன்கு தூளாக்கப்பட்டு திணிவு ரீதியில் 70% H2SO4 கரைசலுடன் கலக்கப்பட்டு 4 – 6 வாரம் விடப்படும். இதன் போது super phosphate உருவாகும்.
2 Ca5(PO4)3 X + 7H2SO4→ 3Ca(H2PO4)2 + 7CaSO4 + 2HX
70% Super
phosphate
∗மேற்படி முறைக்கு பதிலாக Apatite ஐ MgSiO3 உடன் சேர்த்து வெப்பப்படுத்தி உருகிய நிலையில் சடுதியாக நீரில் இடும்போது Mg3(PO4)2 உருவாகும்.
அதேபோல் Apatite உடன் ஒப்பிடும்போது அதன் கரைதிறன் உயர்வாகும்.
2Ca5(PO4)3 + 10MgSiO3→ 3Mg3(PO4)3 + 10CaSiO3 + MgX2
இம்முறை இலங்கைக்கு கூடுதலாகப் பொருந்தும். ஏனெனில் உடவளவையில் உள்ள Serpentirine எனும் களிமத்தில் MgSiO3 உயர்ந்தளவில் காணப்படும்.
சல்பூரிக் அமில பெரும்படி தயாரிப்பு (தொடுகைமுறை)
− கந்தகம் அல்லது கந்தகத்தைக் கொண்ட கனியம் வளி,நீர் ஆகியவை மூலபொருட்களாகப் பயன்படும்.
− சல்பைட்டு இருக்கைகளிலிருந்து நாகம்,ஈயம் போன்ற உலோகங்கள் பிரித்தெடுக்கப்படும் பொழுது கந்தகவீரொட்சைட்டு உருவாகும்.
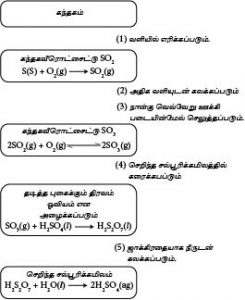
−கந்தகவீரொட்சைட்டுக்கும்,ஒட்சிசனுக்குமிடையிலான தாக்கம் ஓர் மீளும் தாக்கம் ஆகும். கந்தகமூஒட்சைட்டு தொடர்ந்து கந்தகவீரொட்சைட்டும் ஒட்சிசனுமாக பிரிகையடையும். எனவே கலவையை ஊக்கிகளின் பல படுக்கைகள் மேலாக செலுத்துவதன் மூலம் வாயுக்கள் மேலும் மேலும் தாக்கமடைய விடப்படும்.
− கந்தகமூஒட்சைட்டு இரண்டும் ஊக்கிபடுக்கைகளுக்கிடையில் அகற்றப்படுவதன் மூலம் விளைவின் அளவு கூட்டப்படும்.
− கந்தகமூஒட்சைட்டு உருவாவதற்கான இத்தாக்கம் ஓர் புறவெப்பமாக இருப்பதுடன் 3 mol வாயுக்கள் தாக்கமடைந்து இரு mol விளைவை உருவாக்கும். எனவே இலிசற்றிலியரின் தத்துவத்திற்கினங்க உயர் விளைவு SO3 உயர் அமுக்கத்திலும்,தாழ் வெப்பநிலையிலும் பெறப்படும்.
–நடைமுறையில் 450ºC வெப்பநிலை தெரிவு செய்யப்பட்டது. இதுவே தாக்கவேகத்தை அனுமதிக்கப்படக் கூடிய மட்டத்திலும் குறையாது வைத்திருக்க உபயோகிக்கக்கூடிய தாழ் வெப்பநிலையாகும். சாத்தியமான தாழ்வெப்பநிலை பயன்படுத்தப்படுவதற்கு வேறு காரணங்களும் உள்ளன. எரிபொருள் செலவீனமும் வெப்பநிலை அதிகரிப்புடன் அரண்கள் அரிப்புக்கு உள்ளாகும் வீதமும் அதிகரித்தலாகும்.
–450ºC இல் மாறல் 97 வீதமாகும். இவ்வுயர் மாற்றல் வீதம் வளிமண்டல அமுக்கத்தில் நடைபெறுவதனால் அமுக்க அதிகரிப்பு தேவையற்ற ஒன்றாக அமைகின்றது.
சல்பூரிக்கமிலத்தின் உபயோகங்கள்:-
(1) பொசுபேற்று வளமாக்கிகளின் பெரும்படி தயாரிப்பு.
(2) அமோனியம் சல்பேற்று வளமாக்கிகள் தயாரிப்பு.
(3) தொகுப்பு நார்களாகிய ரேயோன்,பிளாஸ்திக்கு பெரும்படி தயாரிப்பு.
(4) பற்றரி அமில உற்பத்தி.
(5) உலோகத்தாது செய்முறை ஒழுங்குகளில்.
(6) சாயங்கள்,வெடிமருத்துகள் தயாரிப்பு.
(7) அழுக்ககற்றிகளின் தயாரிப்பில்.
